
23 gennaio 2019
Protezione intellettuale: la sfida degli anticorpi
Gli anticorpi sono proteine plasmatiche (immunoglobuline) appartenenti alla famiglia delle gammaglobuline e sono prodotti dagli organismi animali, uomo compreso, allo scopo di riconoscere le sostanze dannose che entrano nell’organismo e attivare il sistema immunitario preposto a distruggerle.
Sono prodotti dai linfociti, di cui nello stato inattivo popolano la membrana cellulare esterna (anticorpi di membrana) e danno luogo alla cosiddetta immunità umorale, distinta dall’immunità cellulo-mediata operante tramite riconoscimento delle particelle estranee da parte dei linfociti T.
Proprio la capacità di riconoscere in modo specifico le cellule estranee e attivare i naturali meccanismi per la loro distruzione ha fatto sì che gli anticorpi abbiano assunto nell’ultimo ventennio uno ruolo sempre più di primo piano come active pharmaceutical ingredients nello sviluppo di nuovi interventi diagnostici e terapeutici, in modo particolare nel campo della cura dei tumori (ad esempio rituximab, trastuzumab, cetuximab), come immunosopressori (ad esempio infliximab, omalizumab, daclizumab), come inibitori dell’angiogenesi (bevacizumab) o come potenziatori della risposta immunitaria antitumorale (pembrolizumab, nivolumab). Gli anticorpi sono spesso utilizzati anche in forma coniugata con farmaci, tossine, sostanze radioattive o enzimi attivatori di un prodrug, in quanto permettono di sviluppare strategie di drug targeting mirate a precisi bersagli recettoriali.
La grandissima variabilità strutturale e funzionale degli anticorpi - basti pensare che si stima esistano almeno 109 antigeni diversi - rende il loro sviluppo una sfida particolarmente ambiziosa per le aziende farmaceutiche, anche dal fondamentale punto di vista della loro protezione brevettuale. Il tema è stato oggetto di una ricerca condotta dal gruppo dell’Università di Bologna guidato da Patrizia Rampinelli in collaborazione con la Società Italiana Brevetti (Sib), i cui risultati sono stati recentemente pubblicati su Nature Biotechnology [1]. Ce li illustra Claudio Germinario, esperto brevettuale biotech di Sib e prima firma dell’articolo.
Un capitolo a sé della brevettabilità
«Gli anticorpi, soprattutto se sono anticorpi monoclonali, rappresentano una sfida innanzitutto per gli scienziati che li studiano. Rappresentano poi un capitolo particolare della brevettabilità, in quanto un anticorpo è normalmente il risultato di una selezione tra molteplici possibilità, in cui s’inseriscono e si sovrappongono settori differenti della brevettabilità. Innanzitutto quello relativo alle sostanze biologiche naturali, in particolare quelle di origine umana o animale, poi quello tipico delle invenzioni di selezione, che rappresentano di per sé una sottoclasse brevettuale», spiega Claudio Germinario.
Lo studio ha individuato quattro diversi capitoli generali rilevanti per la brevettabilità di un anticorpo (la brevettabilità delle proteine, la loro caratterizzazione strutturale o funzionale, le invenzioni di selezione e le invenzioni di applicazione terapeutica) e ha condensato in otto diversi casistiche le differenti possibilità che si vengono a creare secondo la normativa e la pratica brevettuale europea (vedi tabella).
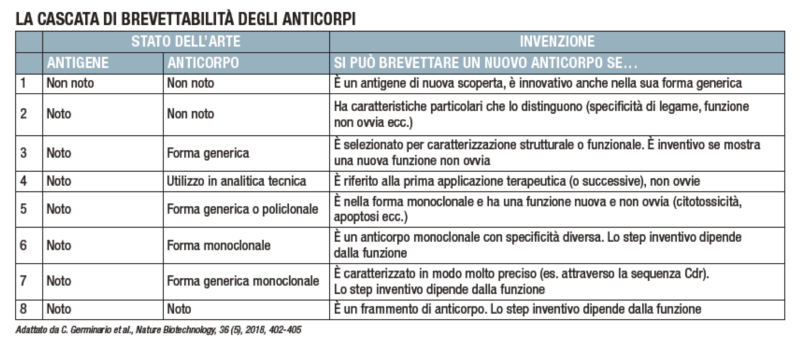
La brevettabilità della proteina
Gli anticorpi, sia policlonali che monoclonali, sono proteine “naturali”, e come tali sono brevettabili come invenzione biotecnologica (EPC regole 26-30 sol). Solo nella misura in cui la proteina è isolata dal suo contesto naturale o prodotta attraverso un procedimento tecnico. La mera “scoperta” dell’esistenza di sostanze disponibili in natura in assenza di un qualsiasi passaggio tecnico è, infatti, esclusa dalle fattispecie che possono essere oggetto di protezione da brevetto. «Questo è il primo punto fondamentale: gli anticorpi policlonali sono tradizionalmente prodotti in animali, ma successivamente estratti e purificati. Gli anticorpi monoclonali sono prodotti da ibridomi, ovvero cellule di fusione tra linfociti B ottenuti normalmente da un animale immunizzato (di solito topi) con cellule di mieloma (un tumore del sangue che colpisce i linfociti B). In questo modo gli ibridomi posso essere resi immortali», spiega Germinario.
Il procedimento che porta all’ottenimento di anticorpi monoclonali, quindi, è decisamente tecnico poiché avviene per lo più in laboratorio a partire da cellule animali e produce proteine che non necessariamente esistono in natura e che, in ogni caso, vengono successivamente isolate e purificate dal loro contesto cellulare.
La caratterizzazione strutturale o funzionale di un anticorpo
«La caratterizzazione strutturale di una sostanza, cioè la descrizione della sua struttura chimica, è la forma tipica utilizzata per le rivendicazioni delle sostanze di sintesi basso-molecolari, pensiamo ai medicamenti tradizionali (non dei biologici), che nel 90% dei casi sono caratterizzati strutturalmente appunto mediante una formula chimica. Questa caratterizzazione, in generale, è preferita dall’Ufficio brevetti europeo (European Patent Office - Epo) per la protezione brevettuale di nuove molecole. Per le sostanze dotate di attività farmacologica o biologica la caratterizzazione può però essere anche di tipo funzionale, cioè basata sulla capacità della sostanza di svolgere una certa funzione. In questo caso, la sostanza non è definita per quello che è, ma per quello che fa. L’anticorpo è l’esempio tipico di caratterizzazione funzionale, in quanto la sua proprietà essenziale è la capacità di legare selettivamente un antigene. D’altra parte, la caratterizzazione strutturale di un anticorpo può essere molto complessa», spiega Claudio Germinario.
Non esiste una scelta migliore tra le due strade alternative per proteggere una struttura proteica, il discrimine è dato dallo stato della tecnica, che deve essere valutato preventivamente alla stesura del brevetto. «Proteggo quello che lo stato dell’arte mi permette di proteggere», sintetizza l’esperto. Se l’anticorpo può essere caratterizzato funzionalmente, potrebbe risultare del tutto inutile spendere tempo e denaro per caratterizzarlo strutturalmente. Al contrario, se una definizione strutturale è inevitabile, occorrerà descrivere nel dettaglio la sequenza amminoacidica dell’anticorpo (in toto o in parte). Di norma questo tipo di attività è mirata a chiarire solo le sequenze aminoacidiche delle regioni variabili dell’anticorpo o ancor meglio delle regioni ipervariabili, le così dette complementarity determining region (CDR), che sono direttamente coinvolte nel riconoscimento e legame dell’antigene.
«Se avessi libertà di scelta, eviterei sempre la caratterizzazione strutturale, poiché quando si definisce una sostanza con la sua formula chimica, si protegge quella sostanza puntuale e null’altro, salvo che vengano adottati strategie particolari come l’uso di formule generiche - spiega il patent attorney di Sib - Con la caratterizzazione funzionale, invece, definendo la capacità dell’anticorpo di riconoscere e legare selettivamente un antigene, si proteggono tutti quegli anticorpi (un’intera famiglia) che condividono quella stessa funzione, indipendentemente dalla loro struttura». La caratterizzazione funzionale protegge la capacità di legame specifico con un determinato antigene (anticorpi policlonali) o con un determinato sito antigenico di una proteina (anticorpi monoclonali). La caratterizzazione funzionale, quindi, conferisce una protezione molto più ampia, e sicuramente preferibile per proteggere nuovi anticorpi, ma potrebbe non essere praticabile a causa dell’esistenza di altri brevetti nello stato dell’arte. «Se ho una generica descrizione di un anticorpo policlonale contro un certo recettore, non posso caratterizzare un secondo anticorpo con lo stesso livello di genericità perché il secondo anticorpo non soddisferebbe il requisito di novità», sottolinea Claudio Germinario.
L’invenzione di selezione
Quando partendo da un insieme di composti noti si selezioni un sottogruppo più ristretto di composti che condividono tutti una stessa caratteristica, si pongono i presupposti per un’invenzione di selezione. Qui scatta il gradino successivo nella valutazione di brevettabilità di un anticorpo che è spesso il risultato di una selezione. Ovvero affinché un nuovo anticorpo specifico per un certo antigene sia brevettabile, questo dovrà essere definito in maniera più precisa e circoscritta rispetto a quelli specifici per lo stesso antigene e già genericamente descritti nell’arte anteriore. Per esempio, se l’arte anteriore descrive dei generici anticorpi anti-proteina K, una sottofamiglia selezionata di anticorpi specifici per una regione particolare della stessa proteina, o per uno specifico sito antigenico della stessa potrà essere brevettata. Anche una sottofamiglia di anticorpi definiti attraverso la sequenza aminoacidica delle regioni variabili o ipervariabili potrà ugualmente essere brevettata. Spesso è molto complicato capire in che posizione ci collochiamo rispetto all’arte anteriore, per questo la brevettazione degli anticorpi è una sfida anche per il patent attorney», aggiunge l’esperto. Tuttavia esiste una condizione addizionale che l’invenzione di selezione, per essere brevettabile, deve soddisfare. Vale a dire, il gruppo selezionato deve produrre un nuovo effetto tecnico precedentemente non riconosciuto e descritto. Ad esempio, la sottofamiglia selezionata potrebbe svolgere funzioni farmacologiche non riconosciute precedentemente oppure essere in grado di attivare un particolare processo fisiologico, come l’apoptosi, o di ridurre la risposta immunitaria.
L’attività farmacologica
«Parlando in generale di un anticorpo non ci si colloca necessariamente nel settore farmaceutico, potremmo collocarci anche nel settore analitico, o diagnostico in vitro. Finora abbiamo considerato anticorpi caratterizzati dalla capacità di legare un certo antigene, a prescindere dall’effetto terapeutico scatenato da questo legame», sottolinea Germinario. L’ultimo stadio nella possibilità di protezione brevettuale vede entrare in scena proprio l’attività farmacologica e terapeutica che gli anticorpi in esame possono vantare. Un tipo di attività che è possibile dimostrare già con test pre-clinici in vitro e sugli animali, mentre in generale non sono richiesti dati provenienti da studi clinici. «È essenziale disporre di questo tipo di dati per poter depositare un brevetto di applicazione terapeutica, in quanto si ritiene che l’ottenimento dell’effetto dichiarato sia parte integrante dell’invenzione», aggiunge l’esperto. Alla data di deposito della domanda di brevetto, che di solito avviene all’inizio del percorso di sviluppo di una nuova sostanza attiva, è molto probabile, anzi la regola, che non siano ancora disponibili dati clinici, e di norma gli uffici brevetti sia a livello nazionale che europeo accettano dati preliminari disponibili, nella misura in cui questi riflettano “plausibilmente” un’applicazione terapeutica reale. «Plausibilmente significa che per l’esperto che legga questi dati deve essere abbastanza ovvio che si arriverà a una applicazione terapeutica: il che non vuol dire che quella sostanza diventerà necessariamente un medicamento, ma che svilupperà caratteristiche farmacologiche che potenzialmente potrebbero portarla a diventare un medicamento», spiega il patent attorney. Il cammino dello sviluppo è, infatti, molto impervio e la maggior parte dei candidati farmaci cadono prima di aver raggiunto il traguardo per una molteplicità di motivi, tra cui ad esempio una tossicità troppo elevata o costi di produzione non accettabili. «Questo tipo di considerazioni, che sbarrano la strada alla stragrande maggioranza dei candidati medicamenti, sono però irrilevanti per l’Epo. I risultati dei test in vitro permettono normalmente già di rivendicare l’applicazione farmaceutica di un anticorpo, ad esempio, come antitumorale. Non si brevetta necessariamente ed esclusivamente il farmaco finale, si brevetta la realizzazione di un’invenzione che potenzialmente potrà portare al farmaco», aggiunge Germinario. Infine è importante ricordare che le regole brevettuali escludono la possibilità di proteggere metodi terapeutici. Quello che può venire protetto è la sostanza farmacologicamente attiva in funzione della sua applicazione terapeutica, anche nel caso in cui la sostanza stessa sia già stata descritta per altre applicazioni.
Le nuove applicazioni terapeutiche
«La normativa relativa al settore farmaceutico permette possibilità di protezione assai ampie anche quando la sostanza in quanto tale sia già nota o sia già nota come medicamento. Pensiamo, ad esempio, a un anticorpo già descritto nell’arte anteriore per una particolare applicazione non-terapeutica: qualcuno scopre che lo stesso ha anche un’efficacia come antitumorale. Ebbene, quello stesso anticorpo può essere ri-brevettato in funzione della sua applicazione terapeutica, con una rivendicazione che si definisce product-for-use claim o purpose-limitated product claim». Si tratta in questo caso, spiega l’esperto, di una rivendicazione di prodotto che rivendica l’anticorpo per l’uso nel trattamento terapeutico del cancro.
Questo tipo di approccio permette di proteggere lo stesso anticorpo per molte applicazioni terapeutiche diverse, purché naturalmente per ognuna di esse possa venire provata la caratteristica di innovatività rispetto alla prior art. In linea di principio anche il processo produttivo usato per ottenere l’anticorpo può essere protetto, anche se essendo un tipo di procedura altamente standardizzata che segue procedure note, di solito non si presenta questa possibilità.
Il deposito del materiale microbiologico
«Come per tutti i microrganismi, batteri e cellule, anche le cellule usate per produrre gli anticorpi - se non possono essere descritte in una maniera sufficientemente completa da essere ripetibili dall’esperto che legge il brevetto - devono essere depositate in accordo col trattato di Budapest presso organizzazioni internazionali che ne garantiscano l’accessibilità a tutti quelli che lo richiedono», spiega Claudio Germinario. Tipico è il caso degli ibridomi usati per la produzione degli anticorpi monoclonali, che sono cellule ingegnerizzate ibridi di cellule umane e di topo che potrebbero non essere altrimenti facilmente riproducibili. «Nel brevetto si danno le indicazioni del deposito, come il nome dell’istituto e il numero di deposito», aggiunge l’esperto. Lasciamo quindi ai lettori interessati il navigare più in profondità nella cascata di possibilità di brevettazione descritta dagli otto casi identificati nell’articolo del gruppo dell’Università di Bologna, che definiscono le condizioni sempre più stringenti per poter rivendicare una nuova sottofamiglia anticorpale sulla base di nuovo effetto tecnico o, infine, terapeutico.
Società Italiana Brevetti - Consulenti in Proprietà Intellettuale
Articolo pubblicato nel Notiziario Chimico Farmaceutico, ottobre 2018
1. C.Germinario, S.Bertoli, P. Rampinelli, M. Cini, Nature Biotechnology, 36 (5), 2018, pp. 402-405









